为贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》要求,国家局加强医疗器械临床试验监督管理,查处临床试验违法违规尤其是弄虚作假行为,强化申请人和临床试验机构的法律意识、诚信意识、责任意识和质量意识。同时,为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家食品药品监督管理总局组织制定医疗器械技术审查指导原则,开启了医疗器械审批的高标准时代。奥咨达作为高端医疗器械临床注册专家,结合药智数据库,带您一窥2016高速发展的医疗器械审评情况。
一.医疗器械注册申请受理情况
根据最新统计,2016年国家食品药品监督管理总局(CFDA)共受理16929个医疗器械审批申请。截止到2016年12月31日,食品药品监管总局共受理医疗器械注册14770项。与2015年(9396项)相比,达到57%的大幅度上升。其中首次注册1777项,延续注册5231项,许可事项更变注册7762项。同时,总局共对1504项医疗器械申请项目不予注册。

(一)整体受理情况
2016年,受理境内医疗器械(含体外诊断试剂)注册申请5304项,受理进口医疗器械(含体外诊断试剂)注册申请9466项。
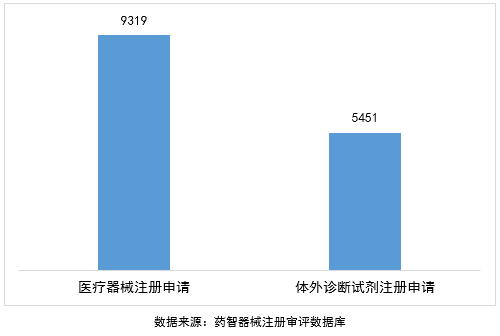
按注册品种划分,医疗器械注册申请9319项,体外诊断试剂注册申请5451项。
按注册形式区分,首次注册申请1777项,延续注册申请5231项,许可事项变更申请7762项。
(二)国内外情况
1.境内医疗器械注册受理情况
2016年,境内医疗器械注册共受理5304项。其中,医疗器械注册申请3124项,体外诊断试剂注册申请2180项。
从注册形式看,首次注册申请1001项,占40%;延续注册申请1595项,占23%;许可事项变更注册申请2708项,占37%。
2.进口医疗器械注册受理情况
2016年,进口医疗器械注册受理共9466项。其中,医疗器械注册申请6195项,体外诊断试剂注册申请3271项。
从注册形式看,首次注册申请776项,占8%;延续注册申请3636项,占38%;许可事项变更注册申请5054项,占53%。
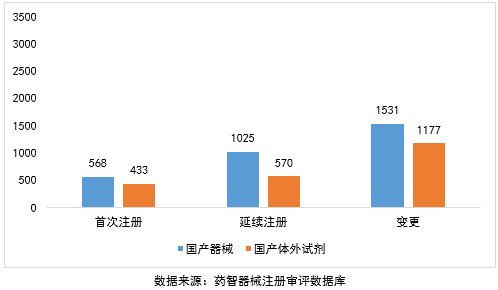

综上,国产器械与进口器械均是延续注册多于首次注册。在进口器械中延续注册大幅度多于进口首次注册于进口变更。同时,国产器械首次注册(1001项)多于进口器械首次注册(776项)。然而,国产器械在延续和变更注册方面,大幅度小于进口器械,尤其是国产体外试剂。从侧面上体现了中国目前市场仍然以进口医疗器械作主流,国内医疗器械成长空间大。而且近年来国产替代的兴起,国产医疗器械行业还有很大的发展空间。
 如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。
如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。

