国家也正鼓励高品质仿制药的发展。早在2012年1月份,国务院就曾印发《国家药品安全“十二五”规划的通知》,提出其主要任务与目标之一是全面提高仿制药质量,“分期分批与被仿制药进行质量一致性评价,其中纳入国家基本药物目录、临床常用的仿制药在2015年前完成,未通过质量一致性评价的不予再注册,注销其药品批准证明文件。”2016年3月5日,国务院下发《关于开展仿制药质量与疗效一致性评价的意见》,单独出台针对性政策,标志我国仿制药一致性评价的改革大幕正式拉开。2017年一致性评价相关政策也跟着进一步落地与完善。
进入到2018年,中国医药行业步入新的发展阶段,仿制药通过国家一致性评价实现进口替代。
2018年4月,国务院《关于改革完善仿制药供应保障及使用政策的意见》的发布,无疑将对我国仿制药产业带来了指导性意见。《意见》明确了鼓励仿制药的药品范围:“临床必需、疗效确切、供应短缺”的药品。此外,鼓励仿制重大传染病防治和罕见病治疗所需药品、处置突发公共卫生事件所需药品、儿童使用药品以及专利到期前一年尚没有提出注册申请的药品。
另外,12月国家卫生健康委等12部门发布的《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》,其中提出,要及时发布鼓励仿制的药品目录。根据临床用药需求,2019年6月底前,发布第一批鼓励仿制的药品目录,引导企业研发、注册和生产。2020年起,每年年底前发布鼓励仿制的药品目录。
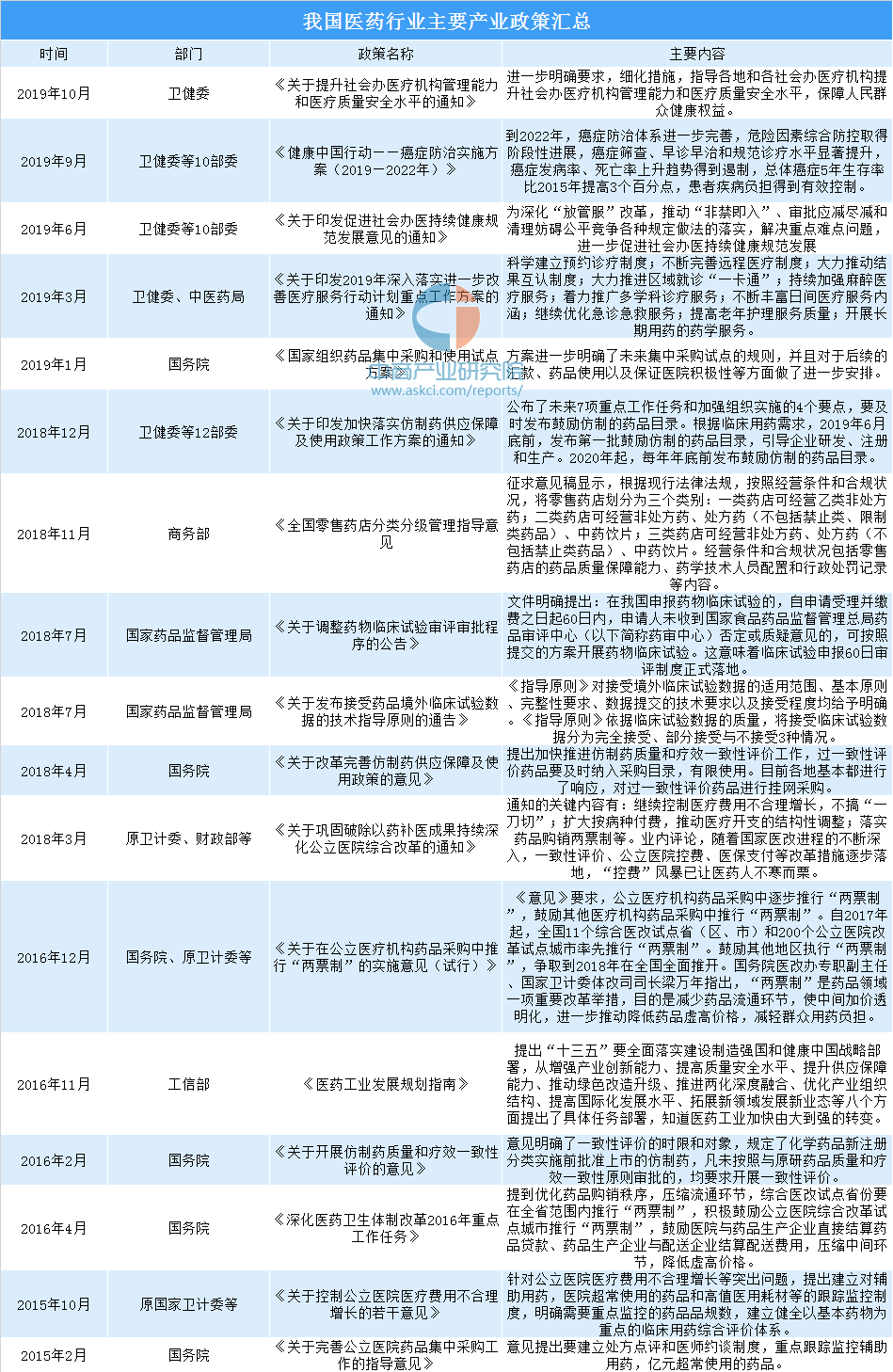
资料来源:中商产业研究院整理
更多资料请参考中商产业研究院发布的《2019-2024年中国医药行业投融资及发展前景研究报告》,同时中商产业研究院还提供产业大数据、产业规划策划、产业园策划规划、产业招商引资等解决方案。
 如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。
如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。

