中商情报网讯:创新药是指具有自主知识产权专利的药物。相对于仿制药,创新药强调化学结构新颖或新的治疗用途。随着政策环境的不断优化,在国家对于中国自主创新药的支持下,创新实力的不断迭代,中国已然有不少创新品种正在加速走向世界。
市场现状
1.市场规模
伴随着创新药审评审批等政策的出台以及经济快速发展带来创新药市场化提速,创新药在医药市场结构的比重逐渐加大。2021年,在中国医药市场中,创新药占比39.6%,我国也正在经历“仿制药-难仿药-同类最佳-同类首创”的转变与突破。数据显示,2022年我国创新药市场规模达6785亿元,由于创新药物相关政策利好、医疗保险调整、医药企业研发支出增加等,预计2023年中国创新药市场规模将增长至7789亿元。
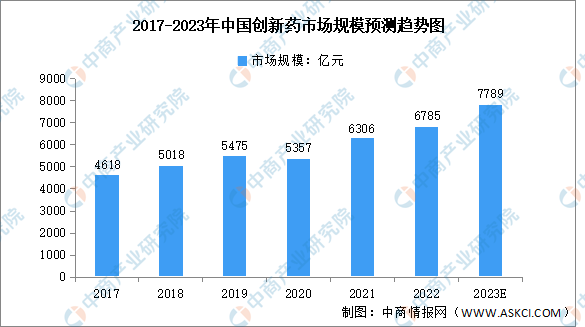
数据来源:弗若斯特沙利文、中商产业研究院整理
2.获批数量
近年来,在政策的支持下,我国新药审评审批不断提速,创新药正加速落地。2022年,NMPA共批准超40款创新药上市,创新药行业市场发展前景广阔。随着中国各新药审评审批政策的协同执行,2021年新药审评审批全面加速,新药获批数目创历史新高,NMPA批准注册的创新药数量达83个。2022年上市创新药数量回归为49个。
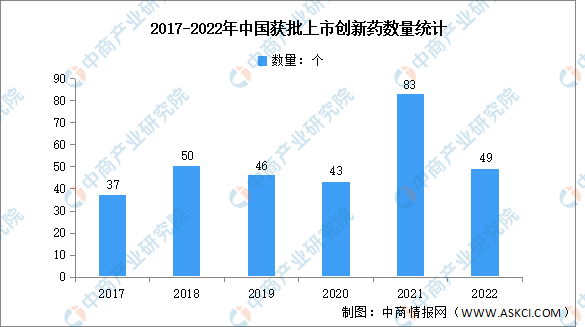
数据来源:医药魔方、中商产业研究院整理
发展前景
1.创新药治疗需求旺盛,市场持续扩容
创新药仍然是药品领域最有潜力的赛道之一。随着我国人口老龄化进程加速、经济水平提升、健康意识增强推升医疗需求,而创新药是多种重大疾病主要解决方案,行业迎来发展机遇并快速发展。尽管创新药板块此前在政策、出海不利、疫情等压力下出现波动,但随着出台的医保政策趋于温和、审评政策不鼓励内卷、具有全球竞争力的品种的数量逐步增多,行业基本面出现边际转好,真正具备临床价值和进度领先的产品有望强化市场优势。
2.中国新药上市加速通道种类与机制已经接近主要发达国家和地区
在审评审批效率方面,我国的审评审批速度曾经饱受诟病。经过一系列改革,目前我国在药物的审评审批效率方面有了很大的改善。根据我国2020年新版《药品注册管理办法》,目前我国有四个新药上市注册加速通道,包括:突破性治疗药物、附条件批准、优先审评审批和特别审批程序,对于有明显临床价值的新药,缩短审评时限,并且提供相应的加速审评措施。目前,中国新药上市加速通道在种类和机制上已经接近主要发达国家和地区。
3.新药审评推进供给侧改革,改善创新药内卷
近年来,创新药审评政策有望改善创新药内卷环境,长期利好研发高顺位企业。自2021年7月以来,CDE公开征求肿瘤药物、单臂临床试验相关指导原则的意见,新药审评政策趋向于:1)对随机对照多中心试验支持下的上市流程以及真正针对未满足临床需求的倾斜;2)压缩仿创品种空间并大幅改善内卷竞争格局,类似PD-1/PD-L1抗体领域的激烈竞争导致的价格体系崩溃出现概率降低;3)长期有利于推动真正创新品种临床的大范围应用。
更多资料请参考中商产业研究院发布的《中国创新药市场前景及投资机会研究报告》,同时中商产业研究院还提供产业大数据、产业情报、产业报告、行业白皮书、可行性研究报告、调查评估、产业规划、园区规划、产业链招商图谱、产业招商指引、项目包装策划、产业招商&推介会等咨询服务。
 如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。
如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。

