中商情报网讯:近年来,我国加速了医药行业的改革速度,尤其是2015年以来,一系列重大医疗改革政策密集发布。
资料来源:中商产业研究院整理
①医药制造行业发展规划
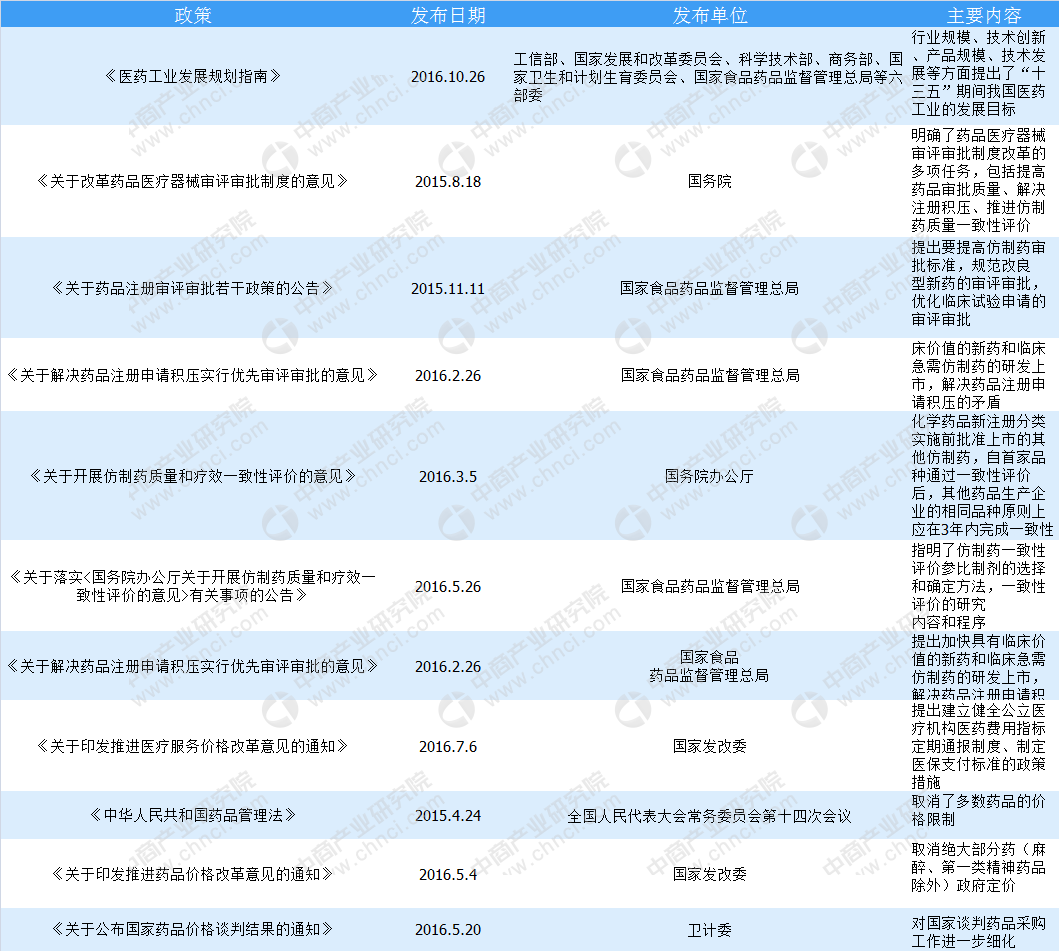
2016年10月26日,工信部、国家发展和改革委员会、科学技术部、商务部、国家卫生和计划生育委员会、国家食品药品监督管理总局等六部委联合发布了《医药工业发展规划指南》,从行业规模、技术创新、产品质量、绿色发展、职健康元药业集团股份有限公司配股申请文件配股说明书1-1-58能制造、供应保障、组织结构、国际化等方面提出了“十三五”期间我国医药工业的发展目标。其中,行业规模方面的发展目标为整体主营业务收入年均增长超过10%。
②关于医药研发的支持政策
近年来,我国出台的医药研发的支持政策主要集中在鼓励优质创新药研发和减少在审药品积压等方面。
2015年8月18日,国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发[2015]44号),明确了药品医疗器械审评审批制度改革的多项任务,包括提高药品审批质量、解决注册积压、推进仿制药质量一致性评价、加快创新药的审评审批、开展药品上市许可持有人制度试点、落实申请人申报主体责任、及时发布药品供求和申报信息等。
2015年11月11日,国家食品药品监督管理总局发布《关于药品注册审评审批若干政策的公告》(2015年第230号),提出要提高仿制药审批标准,规范改良型新药的审评审批,优化临床试验申请的审评审批,化学药生物等效性试验由审批制改为备案制,实行同品种集中审评,对已经受理的相同品种,按照统一的审评标准和尺度组织力量进行集中审评,允许申请人主动撤回不符合条件的药品注册申请。
2016年2月26日,国家食品药品监督管理总局发布《关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管[2016]19号),提出加快具有临床价值的新药和临床急需仿制药的研发上市,解决药品注册申请积压的矛盾。
③药品生产相关政策
近期,我国药品生产的相关政策主要集中在仿制药的一致性评价方面。
2016年3月5日,国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》(国办发[2016]8号),明确提出“国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价;逾期未完成的,不予再注册。化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。”
2016年5月26日,国家食品药品监督管理总局发布《关于落实<国务院办公厅关于开展仿制药质量和疗效一致性评价的意见>有关事项的公告》(2016年第106号),指明了仿制药一致性评价参比制剂的选择和确定方法,一致性评价的研究内容和程序。上述期限内需完成一致性评价的仿制药有近300个品种,涉及到1,883家企业,批文数约1.8万个。因此,该项政策对我国仿制药的生产具有重大影响。
 如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。
如发现本站文章存在版权问题,烦请联系editor@askci.com我们将及时沟通与处理。

